 6
6
峦灵是行业内**的咨询公司,汇聚了来自法规、等各领域对法规有深刻理解的人士及*,致力为企业提供一站式、*、系统化的技术咨询服务, 帮助企业向**市场提供*、有效和合规的产品。
CE技术文件或设计文档(Class III)是相当于国内(中国)在产品上市前递交给药监局进行审的注册文件,是对所涉及的一个综合*的的描述,旨在表明产品符合欧洲指令的要求。因此,编写产品的技术文件或设计档案是欧洲CE认证过程中的非常关键的步骤,特别是在目前欧洲和公告机构对技术文档的监管和估日益加严的背景下,制造商准备的CE技术文件的质量往往成为CE认证的核心和瓶颈。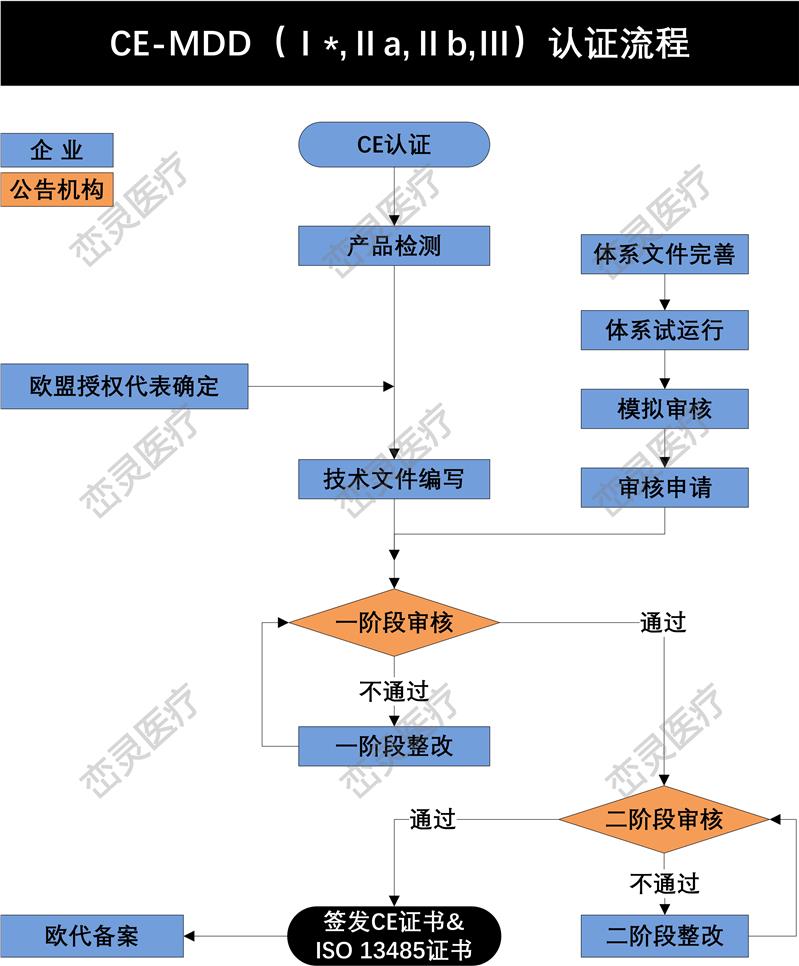
根据欧洲法规的要求,制造商应起草符合性声明,对于加贴CE标志上市的产品的符合性负有责任。因此,制造商在产品进入欧洲市场前,需要估并选定适用的指令和符合性路径,确保产品符合法规要求,然后加贴CE标志。其主要过程包括:
1. 确定根据指令的定义,产品是否属于,哪个欧盟指令适用于所考虑的:指令(93/42 / EEC),体外诊断器械指令(98/79/EC)或有源植入式指令(90/385 / EEC)
2. 确定的分类。
3. 实施质量管理体系(如适用)。大多数公司使用ISO 13485来满足要求。
4. 准备CE标记的技术文件(Technical Documentation)或设计文档(Design Dossier)。
5. 如果制造商在欧洲没有实际的场地,需要任命一位欧洲授权代表,代表制造商在欧盟境内进行相关的法规联络事宜。
6. 制造商的质量管理体系(QMS)和技术文件/设计文档由公告机构(Notified Body)审核和估。若器械属于I类非灭菌、I类无测量功能或顾客定制产品,则不需要公告机构的介入。
7. 从公告机构处获得CE证书和ISO 13485证书。
8. 起草符合性声明(DoC),其中所涉及的符合相应的指令。
9. 在产品上(包括标签、说明书等)加贴CE标志,并投放欧洲市场。对部分欧洲国家,可能需要在上市前在该国主管当局处进行备案。
10. 维持质量体系和CE证书的有效性。
根据多年的法规实践,峦灵建议将技术文件:
制造商信息:名称、地址、生产场地
产品名称、分类
公告机构的信息以及合格估路径
符合性声明
产品基本介绍:预期用途、规格型号、附件等
标签、使用说明书及语言的要求
基本要求检查表
风险分析和控制的概述
产品符合的法规和标准
产品验证和确认的概述